Termodinamika
termodinamika berasal dari kata termo dan dinamika
termo artinya : suhu
dinamika artinya :perubahan
termodinamika : perubahan suhu
perbedaan suhu dengan perubahan temperatur
suhu:
berlaku untuk 1 benda
lebih spesifik
bersifat khusus
temperatur :
berlaku untuk beberapa / lebih dari 1 benda
mewakili
bersifat umum
proses proses termodinamika :
isotermik : sama suhu
isobarik : sama tekanan (pompa air )
isokhorik : sama volume
adiabatik :berlaku volume,tekanan suhu (shauna)
1.usaha dalam termodinamika
Usaha Luar




termo artinya : suhu
dinamika artinya :perubahan
termodinamika : perubahan suhu
perbedaan suhu dengan perubahan temperatur
suhu:
berlaku untuk 1 benda
lebih spesifik
bersifat khusus
temperatur :
berlaku untuk beberapa / lebih dari 1 benda
mewakili
bersifat umum
proses proses termodinamika :
isotermik : sama suhu
isobarik : sama tekanan (pompa air )
isokhorik : sama volume
adiabatik :berlaku volume,tekanan suhu (shauna)
1.usaha dalam termodinamika
Usaha Luar
Usaha luar dilakukan oleh sistem, jika kalor ditambahkan (dipanaskan) atau kalor dikurangi (didinginkan) terhadap sistem. Jika kalor diterapkan kepada gas yang menyebabkan perubahan volume gas, usaha luar akan dilakukan oleh gas tersebut. Usaha yang dilakukan oleh gas ketika volume berubah dari volume awal V1 menjadi volume akhir V2 pada tekanan p konstan dinyatakan sebagai hasil kali tekanan dengan perubahan volumenya.
W = p∆V= p(V2 – V1)
Secara umum, usaha dapat dinyatakan sebagai integral tekanan terhadap perubahan volume yang ditulis sebagai

Kapasitas kalor C suatu zat menyatakan "banyaknya kalor Q yang diperlukan untuk menaikkan suhu zat sebesar 1 kelvin". Pernyataan ini dapat dituliskan secara matematis sebagai
C = Q/ΔT atau Q = CΔT\
keterangan:
C= Kapasitas Kalor
Q = Qalor
∆T = Kenaikan Suhu
Kapasitas gas kalor adalah kalor yang diberikan kepada gas untuk menaikan suhunya dapat dilakukan pada tekanan tetap (proses isobarik) atau volum tetap (proses isokhorik). Karena itu, ada dua jenis kapasitas gas kalor yaitu:
1. Kapasitas kalor gas pada tekanan tetap
2. Kapasitas kalor pada volum tetap
1. kapasitas kalor gas pada tekanan tetap (Cp)
Kapasitas kalor gas adalah kalor yang diperlukan untuk menaikan suhu suatu zat satu Kelvin pada tekanan tetap. tekanan system dijaga selalu konstan. Karena yang konstan adalah tekanan, maka perubahan energi dalam, kalor, dan kerja pada proses ini tidak ada yang bernilai nol.
Maka secara matematis :
Cp = Q/ΔT = ((5/2PΔV)/(ΔT)) = ((5/2nRΔV)/(ΔT)
Cp = 5/2nR
2. Kapasitas kalor gas pada volum tetap (Cv)
2. Kapasitas kalor gas pada volum tetap (Cv)
Kapasitas kalor pada volum tetap artinya kalor yang diperlukan untuk menaikan suhu suatu zat satu kelvin pada volum tetap. Artinya kalor yang diberikan dijaga selalu konstan.
Karena volume system selalu konstan, maka system tidak bisa melakukan kerja pada lingkungan. Demikian juga sebaliknya, lingkungan tidak bisa melakukan kerja pada system. Jadi kalor yang ditambahkan pada system digunakan untuk menaikan energi dalam sistem.
Maka secara matematis :
Cv = Q/ΔT = (3/2nRΔT)/ΔT
Cv = 3/2nR
Berdasarkan persamaan di atas dapat diperoleh bahwa:
Cp – Cv = 5/2nR – 3/2nR
Cp – Cv = nR
Kapasitas yang diperoleh pada persamaan tersebut adalah untuk gas monoatomik. Sedangkan untuk gas diatomik dan poliatomik tergantung pada derajat kebebasan gas. Dapat digunakan pembagian suhu sebagai berikut:
- Pada suhu rendah (± 250 K): Cv = 3/2nR dan Cp = 5/2nR
- Pada suhu sedang (± 500 K): Cv = 5/2nR dan Cp = 7/2nR
- Pada suhu tinggi (± 1000 K): Cv = 7/2nR dan Cp = 9/2nR
Oleh karena itu, konstanta Laplace γ dapat dihitung secara teoretis sesuai persamaan sebagai berikut:
- Gas monoatomik: γ = Cp/Cv = ((5/2nR)/(3/2nR)) = 5/3 = 1,67
- Gas diatomik pada suhu kamar: γ = Cp/Cv = ((7/2nR)/(5/2nR)) = 7/5 = 1,4
Dengan memasukan nilai Qp danQc sertqa W diperoleh :
C p∆T – Cv∆T = p∆V
(C p – Cv ) = p∆V
C p – Cv= p∆V / ∆T
Akhirnya kita mendapatkan rumus lengkap usaha yang dilakukan oleh gas seperti dibawah ini :
· W = p∆V = p (V2- V1)
· W = nR∆V = nR(T2- T1)
· W = Qp - Qv = (Cp – Cv)∆T
proses proses termodinamika ;
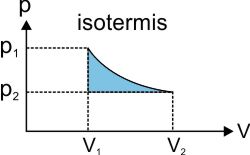
Proses Isotermis (Suhu Konstan)
Usaha luar ga (W) sebanding dengan luas daerah di bawah kurva, rumusnya
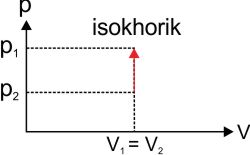
:: Proses Isokhorik (Volume Konstan)
W = p ΔV
karena volume konstan maka ΔV = 0 sehingga
W = 0
W = 0
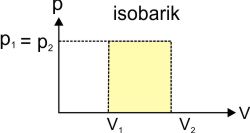
:: Proses Isobarik
W = p ΔV = p (V2-V1)
:: Proses Adiabatik
Yang dimaksud proses adibatik adalah proses perubahan sistem tqanpa ada kalor yang masuk atau keluar dari atau ke dalam sistem. Pada proses adiabatik berlaku persamaan:
p V γ = tetap ; γ = Cp/Cv
γ = tetapan laplace
Cp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
Cp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
karena sistem tidak melepas atau menerima kalor maka usaha yang dilakukan oleh sistem hanya untuk merubah energdalam yang besaranya dapat dirumuskan
W = 1/(γ-1) x (P1 V1 – P2 V2)
hukum 1 termodinamika
"meskipun energi panas telah berubah menjadi usaha luar dan perubahan enrgi dalam,tetapi jumlah seluh energi itu selalu tetap"
Q = W + ∆U
Proses Isotermik
Suatu sistem dapat mengalami proses termodinamika dimana terjadi perubahan-perubahan di dalam sistem tersebut

Proses Isokhorik
Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan (∆V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV.
QV = ∆U
Proses Isobarik
Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W= p∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstan Qp. Berdasarkan hukum I termodinamika, pada proses isobarik berlaku

Sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan
QV =∆U
Dari sini usaha gas dapat dinyatakan sebagai
W = Qp − QV
Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV).
Proses Adiabatik
Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U)

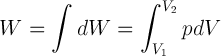
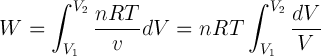






Komentar
Posting Komentar